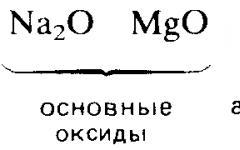ΔΟΚΙΜΗ "ΧΗΜΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ"
Επιλογή 1
1. Η αλληλεπίδραση του νατρίου με το νερό είναι η αντίδραση:
α) εξώθερμο, σύνθετο, αναστρέψιμο. β) εξώθερμο, υποκατάσταση, ετερογενές.
γ) ενδόθερμο, υποκατάσταση, μη αναστρέψιμο. δ) ενδόθερμος, ανταλλακτικός, ομοιογενής.
2. Οι αντιδράσεις οξειδοαναγωγής περιλαμβάνουν:
α) C 2 H 2 + H 2 ↔ C 2 H 6 β) NaCl + AgNO 3 = AgCl ↓ + NaNO 3
γ) CaO + H 2 O = Ca(OH) 2 γ) CH 3 OH + HCl ↔ CH 3 Cl + H 2 O
3. Ο συντελεστής μπροστά από τον τύπο του οξειδωτικού παράγοντα στην εξίσωση για την αντίδραση του αλουμινίου με το βρώμιο είναι ίσος με:
Α'1; β) 2; στις 3; δ) 4.
4. Το άθροισμα των συντελεστών στη συντομευμένη ιοντική εξίσωση για την αντίδραση μεταξύ χλωριούχου σιδήρου( III ) και το υδροξείδιο του καλίου είναι ίσο με:
α) 6; β) 5; στο 4? δ) 3.
N.H. 4 + + OH - = N.H. 3 + Ν 2 Το O αντιστοιχεί στην αλληλεπίδραση των ουσιών:
α) NH 4 Cl και H 2 O β) NH 4 Cl (διάλυμα) και ΚΟΗ (διάλυμα)
γ) NH 3 και H 2 O δ) NH 4 NO 3 και Mg(OH) 2
6 . Δεν υφίσταται υδρόλυση:
α) οξικό νάτριο. β) χλωριούχος ψευδάργυρος.
γ) αιθανόλη. δ) λίπος.
7. Με την υψηλότερη ταχύτητα στο θερμοκρασία δωματίουΤο μαγνήσιο θα αντιδράσει με:
α) διάλυμα HCl 1%. β) Διάλυμα HCl 5%.
γ) Διάλυμα HCl 10%. γ) Διάλυμα HCl 15%.
8. Ποιος θα είναι ο ρυθμός αντίδρασης στους 40˚С, αν στους 20˚С ισούται με 0,4 mol/(l∙h), και με αύξηση της θερμοκρασίας κατά 10˚С αυξάνεται 3 φορές;
α) 0,8 mol/(l∙h); β) 2,4 mol/(l∙h);
γ) 1,2 mol/(l∙h); δ) 3,6 mol/(l∙h).
9. Θερμοχημική εξίσωση για την αντίδραση πλήρους καύσης ακετυλενίου:
2C 2 Ν 2 + 5О 2 = 4СО 2 + 2Η 2 O + 2610 kJ. Όταν χρησιμοποιείτε 1,12 λίτρα ακετυλίνης, θα απελευθερωθεί η ακόλουθη θερμότητα:
α) 1305 kJ; β) 130,5 kJ;
γ) 261 kJ; δ) 62,25 kJ.
10. Χημική ισορροπία στο σύστημα Γ 4 Ν 10 ↔ Γ 4 Ν 8 + Ν 2 – Q μπορεί να μετατοπιστεί στο μέγιστο βαθμό προς τα προϊόντα αντίδρασης όταν:
α) αύξηση της θερμοκρασίας και αύξηση της πίεσης.
β) αύξηση της θερμοκρασίας και μείωση της πίεσης.
γ) μείωση της θερμοκρασίας και αύξηση της πίεσης.
δ) μείωση της θερμοκρασίας και μείωση της πίεσης.
Επιλογή 2
1. Αλληλεπίδραση μεταξύ οξειδίου του χαλκού ( II ) με το υδρογόνο είναι η αντίδραση:
α) υποκατάσταση, καταλυτική, ομοιογενής. β) ανταλλακτικό, ετερογενές, μη καταλυτικό
γ) ενώσεις, αναστρέψιμες, ετερογενείς. δ) υποκατάσταση, ετερογενής, μη αναστρέψιμη.
2. Η ακόλουθη αντίδραση δεν ισχύει για αντιδράσεις οξειδοαναγωγής:
α) CH 4 + O 2 → CO 2 + 2H 2 O β) C 2 H 2 + 2Br 2 → C 2 H 2 Br 4
γ) K 2 O + H 2 O = 2KOH δ) 2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
3. Συντελεστής μπροστά από τον τύπο του αναγωγικού παράγοντα στην εξίσωση αντίδρασης, το διάγραμμα του οποίου
S+HNO 3 → Η 2 ΕΤΣΙ 4 +ΟΧΙ, ισοδυναμεί :
Α'1; β)3; στο 2? δ)4.
4. Το άθροισμα των συντελεστών στη συντομευμένη ιοντική εξίσωση για την αντίδραση μεταξύ ανθρακικού καλίου και υδροχλωρικού οξέος είναι ίσο με:
α) 3; β) 4; στις 5; δ)6.
5. Συντομευμένη εξίσωση ιοντικής αντίδρασης Ba 2+ + CO 3 2- = BaCO 3 Το ↓ αντιστοιχεί στην αλληλεπίδραση:
α) BaCl 2 (διάλυμα) και CaCO 3. β) BaCl 2 (διάλυμα) και K 2 CO 3 (διάλυμα).
γ) Ba(NO 3) 2 (διάλυμα); και CO 2; δ) BaSO 4 και Na 2 CO 3 (διάλυμα)
6. Σε ποια από υδατικά διαλύματαόξινο περιβάλλον;
α) φωσφορικό κάλιο. β) νιτρικό βάριο.
γ) χλωριούχο αμμώνιο. δ) μυρμηκικό νάτριο.
7. Η αντίδραση λαμβάνει χώρα με τη χαμηλότερη ταχύτητα σε θερμοκρασία δωματίου μεταξύ:
α) Fe και H 2 ΕΤΣΙ 4 (rr); β) Cu και O 2
γ) C2H5OH και Na; δ) AgNO 3 (διάλυμα) και NaCl (διάλυμα)
8. Έτσι ώστε η ταχύτητα αντίδρασης να είναι 2A + B → A 2 Το Β δεν άλλαξε όταν η συγκέντρωση της ουσίας Β αυξήθηκε κατά 4 φορές, είναι απαραίτητο:
α) μείωση της συγκέντρωσης Α κατά 4 φορές. β) αύξηση της συγκέντρωσης Α κατά 2 φορές.
γ) μείωση της συγκέντρωσης Α κατά 2 φορές. δ) αφήστε τη συγκέντρωση Α αμετάβλητη.
9. Θερμική επίδραση της αντίδρασης: Γ 6 Ν 12 ΣΧΕΤΙΚΑ ΜΕ 6(t) + 6Ο 2(t) → 6СО 2 (g) + 6Η 2 ΣΧΕΤΙΚΑ ΜΕ (και) , Αν Q αρ. (CO 2 (g) ) = 393,5 kJ/mol, Q αρ. (Ν 2 ΣΧΕΤΙΚΑ ΜΕ (και) ) = 285,8 kJ/mol, Q αρ. (ΜΕ 6 Ν 12 ΣΧΕΤΙΚΑ ΜΕ 6(t) ) = 1273 kJ/mol, ίσο με:
α) 593,7 kJ/mol; β) – 2802,8 kJ/mol;
γ) 2802,8 kJ/mol; δ) 3562,2 kJ/mol.
10. Καθώς η πίεση αυξάνεται, η ισορροπία θα μετατοπιστεί προς τα προϊόντα αντίδρασης στο σύστημα:
α) H 2 + Br 2 ↔ 2НВr; β) PCl 5 (g) ↔ PCl 3 (g) + Cl 2;
γ) C + CO 2 ↔ 2CO; δ) CO + Cl 2 ↔ COCl 2 (g).
Μέγεθος: px
Ξεκινήστε την εμφάνιση από τη σελίδα:
Αντίγραφο
1 Εργασίες Α19 στη χημεία 1. Η αλληλεπίδραση του οξειδίου του νατρίου με το νερό αναφέρεται στις αντιδράσεις 1) σύνδεσης, μη αναστρέψιμης 2) ανταλλαγής, αναστρέψιμης 3) σύνδεσης, αναστρέψιμης 4) ανταλλαγής, μη αναστρέψιμων Το οξείδιο του νατρίου είναι ένα βασικό οξείδιο που αντιδρά βίαια με το νερό για να σχηματιστεί υδροξείδιο του νατρίου. 2. Καθορίστε την αντίδραση υποκατάστασης. 1) 2) 3) 4) Τα σημάδια μιας αντίδρασης υποκατάστασης στην οργανική χημεία είναι τα ακόλουθα: 2 ουσίες σχηματίζονται από 2 ουσίες, ο σκελετός του άνθρακα δεν καταστρέφεται, ένα άτομο ή ομάδα ατόμων αντικαθίσταται από ένα άλλο άτομο ή ομάδα άτομα. Παρατηρούμε αυτά τα σημάδια στην αντίδραση 1. Απάντηση: 1.
2 3. Η αλληλεπίδραση νατρίου και νερού αναφέρεται σε αντιδράσεις 1) ενδόθερμες, καταλυτικές 2) εξώθερμες, καταλυτικές 3) ενδόθερμες, αναστρέψιμες 4) εξώθερμες, μη αναστρέψιμες Αυτή η αντίδραση συμβαίνει με την απελευθέρωση θερμότητας και αερίου υδρογόνου (σημάδι της μη αναστρέψιμης η αντίδραση). 4. Η αλληλεπίδραση του οξυγόνου με το οξείδιο του θείου (IV) αναφέρεται στις αντιδράσεις 1) ένωσης, ενδόθερμης 2) ένωσης, εξώθερμης 3) υποκατάστασης, ενδόθερμης 4) ανταλλαγής, εξώθερμης 2SO2 + O2 = 2 SO3 είναι μια σύνθετη αντίδραση, σχεδόν όλες Οι αντιδράσεις της ένωσης είναι εξώθερμες. Απάντηση: 2.
3 5. Οι αντιδράσεις οξειδοαναγωγής δεν περιλαμβάνουν την αποσύνθεση 1) μεθανίου 2) νιτρικού οξέος 3) χλωριούχου αμμωνίου 4) νιτρικού αμμωνίου Οι αντιδράσεις οξειδοαναγωγής δεν περιλαμβάνουν την αποσύνθεση χλωριούχου αμμωνίου επειδή σχηματίζεται αμμωνία και υδροχλώριο, οι καταστάσεις οξείδωσης των στοιχείων δεν αλλάζουν. Απάντηση: Αλληλεπίδραση μεταξύ γλυκερίνης και υψηλότερης καρβοξυλικά οξέααναφέρεται στις αντιδράσεις 1) ανταλλαγής 2) ισομερισμού 3) προσθήκης 4) εστεροποίησης Η αντίδραση μεταξύ αλκοόλης και οξέος ονομάζεται αντίδραση εστεροποίησης, οδηγεί στον σχηματισμό εστέρα.
4 7. Η αλληλεπίδραση του ανθρακικού καλίου με ένα διάλυμα χλωριούχου μαγνησίου ταξινομείται ως αντίδραση 1) αποσύνθεσης 2) ανταλλαγής 3) υποκατάστασης 4) σύνδεσης Αντίδραση ανταλλαγής είναι μια αντίδραση που συμβαίνει μεταξύ δύο πολύπλοκων ουσιών, ως αποτέλεσμα της οποίας ανταλλάσσουν τους συστατικά. 8. Όταν το διχρωμικό αμμώνιο θερμαίνεται, συμβαίνει μια αντίδραση: 1) ανταλλαγή 2) υποκατάσταση 3) αποσύνθεση 4) σύνδεση Τα άλατα αμμωνίου είναι θερμικά ασταθή. Όταν το διχρωμικό αμμώνιο θερμαίνεται, αποσυντίθεται για να σχηματίσει άζωτο, οξείδιο του χρωμίου (III) και νερό. Απάντηση: 3.
5 9. Οι αντιδράσεις ανταλλαγής περιλαμβάνουν την αλληλεπίδραση μεταξύ 1) αιθυλενίου και νερού 2) υδροχλωρικού οξέος και μαγνησίου 3) ακετυλενίου και βρωμίου 4) οξικού οξέος και υδροξειδίου μαγνησίου Συμβαίνουν αντιδράσεις ανταλλαγής μεταξύ δύο πολύπλοκων ουσιών, ως αποτέλεσμα των οποίων οι ουσίες ανταλλάσσουν το συστατικό τους εξαρτήματα. Από τη λίστα, αυτή είναι η αντίδραση μεταξύ οξικού οξέος και υδροξειδίου του μαγνησίου 2ΣH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O 10. Όταν θερμαίνεται ο νιτρικός χαλκός (II), λαμβάνει χώρα μια αντίδραση: 1) υποκατάσταση 2) ανταλλαγή 3 ) σύνδεση 4) αποσύνθεση Όταν ο νιτρικός χαλκός (II) θερμαίνεται, συμβαίνει μια αντίδραση αποσύνθεσης: 2Cu(NO3)2=2CuO+4NO2+O2
6 11. Η χλωρίωση του βενζολίου στο φως αναφέρεται στην αντίδραση 1) υποκατάστασης 2) προσθήκης 3) ανταλλαγής 4) αποσύνθεσης Σημειώστε - χλωρίωση στο φως και όχι με καταλύτη. Στην περίπτωση αυτή, σχηματίζεται 1,2,3,4,5,6-εξαχλωροκυκλοεξάνιο. Αντίδραση προσθήκης. Απάντηση: Η αλληλεπίδραση του οξειδίου του φωσφόρου (v) με το νερό αναφέρεται στις αντιδράσεις 1) σύνδεσης, ενδόθερμης 2) σύνδεσης, εξώθερμης 3) ανταλλαγής, εξώθερμης 4) υποκατάστασης, εξώθερμης εξώθερμης αντίδρασης της σύνδεσης. Απάντηση: 2.
7 13. Η αλληλεπίδραση του οξειδίου του ασβεστίου με το νερό αναφέρεται στις αντιδράσεις 1) υποκατάστασης, εξώθερμης 2) σύνδεσης, ενδόθερμης 3) σύνδεσης, εξώθερμης 4) ανταλλαγής, εξώθερμης Απάντηση: 3. εξώθερμη αντίδραση της σύνδεσης. 14. Μια αντίδραση της οποίας η εξίσωση σχετίζεται με τις αντιδράσεις 1) οξειδοαναγωγή, υποκατάσταση 2) εξώθερμη, ανταλλαγή 3) ενδόθερμη, σύνδεση 4) καταλυτική, αποσύνθεση Αντιδράσεις που περιλαμβάνουν αλογόνα και υδρογόνο είναι, φυσικά, αντιδράσεις σύνδεσης. Σε αυτή την περίπτωση, αυτή η αντίδραση είναι ενδόθερμη.
8 Απάντηση: Η αλληλεπίδραση του οξυγόνου με το οξείδιο του θείου (IV) αναφέρεται στις αντιδράσεις 1) σύνδεσης, μη αναστρέψιμης 2) σύνδεσης, αναστρέψιμης 3) υποκατάστασης, ενδόθερμης 4) ανταλλαγής, εξώθερμης Η αλληλεπίδραση οξυγόνου με οξείδιο του θείου (IV) με το Ο σχηματισμός οξειδίου του θείου (VI) αναφέρεται σε ένα από τα πιο σημαντικά παραδείγματα αναστρέψιμες αντιδράσεις. 16. Όταν ένα μείγμα σιδήρου και θείου θερμαίνεται, συμβαίνει μια αντίδραση: 1) σύνδεση 2) ανταλλαγή 3) υποκατάσταση 4) αποσύνθεση Όταν δύο αλληλεπιδρούν απλές ουσίεςμόνο μια σύνθετη αντίδραση μπορεί να συμβεί. Απάντηση: 1.
9 17. Η αλληλεπίδραση του θειούχου νατρίου με το υδροχλωρικό οξύ αναφέρεται στις αντιδράσεις 1) υποκατάστασης 2) αποσύνθεσης 3) σύνδεσης 4) ανταλλαγής Αυτή είναι μια αντίδραση ανταλλαγής: 18. Η αλληλεπίδραση του υδρογόνου με το χλώριο αναφέρεται στις αντιδράσεις 1) αποσύνθεσης , ενδόθερμος 2) ανταλλαγή, εξώθερμος 3) σύνδεση , ενδόθερμος 4) ενώσεις, εξώθερμος
10 Η αλληλεπίδραση του υδρογόνου με το χλώριο αναφέρεται στις αντιδράσεις σύνδεσης, εξώθερμη 19. Η αλληλεπίδραση οξυγόνου με λίθιο αναφέρεται στις αντιδράσεις 1) σύνδεσης, ενδόθερμης 2) σύνδεσης, εξώθερμης 3) υποκατάστασης, ενδόθερμης 4) ανταλλαγής, εξώθερμης Αυτό είναι μια αντίδραση σύνδεσης που λαμβάνει χώρα με μεγάλη απελευθέρωση θερμότητας. 20. Η αντίδραση εξουδετέρωσης αντιστοιχεί στην εξίσωση: 1) 2) 3) 4)
11 Εξ ορισμού, μια αντίδραση εξουδετέρωσης είναι η αλληλεπίδραση ενός οξέος και ενός αλκαλίου, σε αυτή τη λίσταυπάρχει μόνο μία τέτοια επιλογή.
Χημική αντίδραση. Συνθήκες και σημεία εμφάνισης χημικές αντιδράσεις. Χημικές εξισώσεις 1. Ποια εξίσωση αντιστοιχεί στην αντίδραση αποσύνθεσης; 2. Ποια εξίσωση αντιστοιχεί στην αντίδραση ανταλλαγής; 3. Ποια
1. Ποια εξίσωση αντιστοιχεί στην αντίδραση αποσύνθεσης; 2. Ποια εξίσωση αντιστοιχεί στην αντίδραση ανταλλαγής; 3. Ποια εξίσωση αντιστοιχεί στην αντίδραση υποκατάστασης; 4. Σε αντίδραση αποσύνθεσης που συνοδεύεται από αλλαγή
1. Από την προτεινόμενη λίστα ουσιών, επιλέξτε δύο ουσίες με καθεμία από τις οποίες ο σίδηρος αντιδρά χωρίς θέρμανση. χλωριούχος ψευδάργυρος χαλκός(ii) πυκνό αραιό θειικό νιτρικό οξύ υδροχλωρικό οξύ
ΥΠΟΥΡΓΕΙΟ ΕΚΠΑΙΔΕΥΣΗΣ ΚΑΙ ΕΠΙΣΤΗΜΗΣ ΤΗΣ ΛΑΪΚΗΣ ΔΗΜΟΚΡΑΤΙΑΣ ΤΟΥ ΛΟΥΓΚΑΝΣΚ ΚΡΑΤΙΚΟ ΙΔΡΥΜΑ ΕΠΙΠΛΕΟΝ ΕΠΑΓΓΕΛΜΑΤΙΚΗΣ ΕΚΠΑΙΔΕΥΣΗΣ ΤΗΣ ΛΑΪΚΗΣ ΔΗΜΟΚΡΑΤΙΑΣ ΤΟΥ LUGANSK "REPUBLICAN CENTER FOR EDUCATIONAL DEVEL"
Εργασίες Α8 στη χημεία 1. Ο ψευδάργυρος αντιδρά με διάλυμα Τα μέταλλα αντιδρούν με διαλύματα αλάτων λιγότερο ενεργών μετάλλων. Mg, Na, Ca περισσότερα ενεργά μέταλλααπό τον ψευδάργυρο, επομένως η αντίδραση με αυτά τα άλατα δεν είναι δυνατή.
Επιλογή 1743654 1. Προσδιορίστε ποια άτομα δύο από τα υποδεικνυόμενα στοιχεία έχουν ένα μη ζευγαρωμένο ηλεκτρόνιο στη θεμελιώδη κατάσταση. 2. Σημειώστε τους αριθμούς των επιλεγμένων στοιχείων στο πεδίο απάντησης. Επιλέξτε τρία στοιχεία
2 Επεξηγηματικό σημείωμαΤο πρόγραμμα αναπτύσσεται με βάση ένα υποχρεωτικό ελάχιστο δευτερεύον (πλήρες) περιεχόμενο γενική εκπαίδευσηστη χημεία. Περιεχόμενα προγράμματος 1. Θέμα και εργασίες της χημείας. Φυσικά φαινόμενα
ΚΑΡΤΕΣ ΕΞΕΤΑΣΕΩΝ ΓΙΑ ΤΗΝ ΚΡΑΤΙΚΗ ΤΕΛΙΚΗ ΠΙΣΤΟΠΟΙΗΣΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΒΑΣΙΚΑ ΕΚΠΑΙΔΕΥΤΙΚΑ ΠΡΟΓΡΑΜΜΑΤΑ ΒΑΣΙΚΗΣ ΓΕΝΙΚΗΣ ΕΚΠΑΙΔΕΥΣΗΣ 2019 1. Περιοδικός νόμοςκαι περιοδικός πίνακας χημικών
Τράπεζα εργασιών 11η τάξη χημεία 1. Ηλεκτρονική διαμόρφωσηαντιστοιχεί σε ένα ιόν: 2. Τα σωματίδια και και και και έχουν την ίδια διαμόρφωση 3. Τα άτομα του μαγνησίου και έχουν παρόμοια διαμόρφωση του εξωτερικού ενεργειακού επιπέδου
Εργασίες 5. Απλό και σύνθετες ουσίες. Ανόργανες ουσίες 1. Ουσίες των οποίων οι τύποι και είναι αντίστοιχα αμφοτερικό υδροξείδιοκαι όξινο αμφοτερικό υδροξείδιο και βάση άλατος και οξύ
ΔΗΜΟΤΙΚΟΣ ΠΡΟΫΠΟΛΟΓΙΣΜΟΣ ΕΚΠΑΙΔΕΥΤΙΚΟ ΙΔΡΥΜΑ Δευτεροβάθμιας Εκπαίδευσης 8 Konakovo «Συμφωνήθηκε» Στα Πρακτικά ShMO του 2016 Επικεφαλής του ShMO «Έγκριση» Διευθυντής MBOU Δευτεροβάθμια εκπαίδευση 8 Konakovo
Τράπεζα εργασιών χημείας βαθμού 10 1. Προπάνιο μεθάνιο αιθάνιο αιθυλένιο 5) ακετυλένιο θα αντιδράσει με καθεμία από τις καθορισμένες ουσίες: υδροχλώριο, υδρογόνο, βρώμιο νερό 2. Κατά την ολοκλήρωση μιας εργασίας από την προτεινόμενη λίστα
Εργασίες A12 στη χημεία 1. Στο σχήμα μετασχηματισμού, οι ουσίες "X" και "Y" είναι αντίστοιχα Ο σίδηρος οξειδώνεται μόνο σε πολύ ισχυρούς οξειδωτικούς παράγοντες (για παράδειγμα, όπως το χλώριο). Σε αντιδράσεις με So: ουσία
Εργασίες Α11 στη χημεία 1. Το θειούχο σίδηρο (II) αντιδρά με ένα διάλυμα καθεμίας από τις δύο ουσίες: Το θειούχο σίδηρο (II) είναι ένα αδιάλυτο άλας, επομένως δεν θα αντιδράσει με άλλα άλατα, αλλά θα αντιδράσει
ΚΑΡΤΕΣ ΕΞΕΤΑΣΕΩΝ ΓΙΑ ΤΗΝ ΚΡΑΤΙΚΗ ΤΕΛΙΚΗ ΠΙΣΤΟΠΟΙΗΣΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΠΡΟΓΡΑΜΜΑΤΑ ΒΑΣΙΚΗΣ ΓΕΝΙΚΗΣ ΕΚΠΑΙΔΕΥΣΗΣ 2018 ΕΙΣΙΤΗΡΙΟ 1 1. Περιοδικός νόμος και περιοδικό σύστημα χημικών στοιχείων Δ.Ι.
Εισιτήρια για τις εξετάσεις μετεγγραφής στη χημεία στην τάξη 8 Εισιτήριο 1 1. Θέμα της χημείας. Ουσίες. Οι ουσίες είναι απλές και πολύπλοκες. Ιδιότητες ουσιών. 2. Οξέα. Η ταξινόμηση και οι ιδιότητές τους. Εισιτήριο 2 1. Μετασχηματισμοί ουσιών.
Τελικό τεστ στη χημεία τάξη 11 με απαντήσεις >>> Τελικό τεστ στη χημεία τάξη 11 με απαντήσεις Τελικό τεστ στη χημεία τάξη 11 με απαντήσεις Στο εργαστήριο οξικό οξύλάβετε σύμφωνα με το σχήμα: 1 2 3 4 Απάντηση: 2 Εργασία
Δημοτικό αυτόνομο εκπαιδευτικό ίδρυμα βασικό ολοκληρωμένο σχολείο Zarubino village Εισιτήρια χημείας Καθηγήτρια χημείας Somova N.Kh. 2012 Εργασίες εξέτασης στη χημεία Θεωρητικά
Ταχύτητα αντίδρασης, η εξάρτησή της από διάφορους παράγοντες 1. Για να αυξήσετε τον ρυθμό αντίδρασης, είναι απαραίτητο να αυξήσετε την πίεση, προσθέστε μονοξείδιο του άνθρακα (1v) ψύξτε το σύστημα, αφαιρέστε το μονοξείδιο του άνθρακα (1v) 2. Ταχύτητα
1. Δεν σχηματίζεται ίζημα κατά την αλληλεπίδραση υδατικών διαλυμάτων και και και 2. Δεν σχηματίζεται ίζημα κατά την αλληλεπίδραση υδατικών διαλυμάτων και και και 3. Σχηματίζεται νερό στην αντίδραση ανταλλαγής ιόντων κατά την αλληλεπίδραση και και και
Εργασίες Α25 στη χημεία 1. Το θειικό οξύ εμφανίζει οξειδωτικές ιδιότητες σε μια αντίδραση, το σχήμα της οποίας είναι: Οι οξειδωτικοί παράγοντες δέχονται ηλεκτρόνια και μειώνουν την κατάσταση οξείδωσης. Θειικό οξύμπορεί να παρουσιάσει οξειδωτική δράση
Κάρτες εξετάσεων στη χημεία για την κρατική (τελική) πιστοποίηση αποφοίτων της 9ης τάξης το ακαδημαϊκό έτος 2010-2011 ΕΙΣΙΤΗΡΙΟ 1 1. Περιοδικός νόμος και περιοδικό σύστημα χημικών στοιχείων του D.I. Mendeleev.
1. ΣΧΕΔΙΑΣΜΕΝΑ ΜΑΘΗΣΙΑΚΑ ΑΠΟΤΕΛΕΣΜΑΤΑ Ενότητα 2. Η ποικιλία των χημικών αντιδράσεων Ως αποτέλεσμα της μελέτης αυτής της ενότητας, οι μαθητές θα αποκτήσουν τις πιο σημαντικές χημικές έννοιες: ταξινόμηση των χημικών αντιδράσεων με διάφορους τρόπους,
Εισιτήριο 4 1. Είδη χημικών δεσμών: ομοιοπολικοί (πολικοί και μη πολικοί), ιονικοί, οι ομοιότητες και οι διαφορές τους. 2. Εμπειρία. Διεξαγωγή αντιδράσεων χαρακτηριστικών οξέων (χρησιμοποιώντας το παράδειγμα του υδροχλωρικού οξέος). Εισιτήριο 5
Θεματικός σχεδιασμός 9η τάξη /σελ Περιεχόμενα Διατύπωση του θέματος του μαθήματος Ώρες Επανάληψη των κύριων ερωτήσεων της 8ης τάξης (3 ώρες). Περιοδικός νόμος και Περιοδικός Πίνακαςχημικά στοιχεία Δ.Ι.
ΕΞΕΤΑΣΗ ΔΟΚΙΜΗ ΣΤΗ ΧΗΜΕΙΑ (ΕΞΩΤΕΡΙΚΗ 9 ΤΑΞΗ) 1. Χημική αντίδραση που συμβαίνει με σχηματισμό ιζήματος α) h 2 SO 4 + BaCl 2 β) HNO 3 + KOH γ) HCl + CO 2 δ) HCl + Ag 2. Με ποια από τις ουσίες α) ανθρακικό
Επιλογή 5 μέρος 1 Κατά την ολοκλήρωση των εργασιών αυτού του μέρους στη φόρμα απαντήσεων M I, κάτω από τον αριθμό της εργασίας που εκτελείτε (A1 - A30), βάλτε το σύμβολο "x" στο πλαίσιο, ο αριθμός του οποίου αντιστοιχεί στον αριθμό από αυτόν που έχετε επιλέξει
Εργασίες Β7 στη χημεία 1. Η φαινόλη αντιδρά με 1) χλώριο 2) βουτάνιο 3) θείο 4) υδροξείδιο του νατρίου 5) νιτρικό οξύ 6) οξείδιο του πυριτίου (IV) Φαινόλες - που περιέχουν οξυγόνο ΟΡΓΑΝΙΚΕΣ ΕΝΩΣΕΙΣ, στο μόριο του οποίου
ΕΙΣΙΤΗΡΙΑ ΧΗΜΕΙΑΣ 10-11 ΤΑΞΕΩΝ. ΕΙΣΙΤΗΡΙΟ 1 1. Περιοδικός νόμος και περιοδικό σύστημα χημικών στοιχείων Δ.Ι. Ο Mendeleev βασίζεται σε ιδέες για τη δομή των ατόμων. Η σημασία του περιοδικού νόμου για
ΠΡΟΓΡΑΜΜΑ ΕΙΣΑΓΩΓΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΣΤΗ ΧΗΜΕΙΑ Ένας υποψήφιος σε πανεπιστήμιο πρέπει να αποδείξει γνώση των βασικών θεωρητικών αρχών της χημείας ως μία από τις πιο σημαντικές φυσικές επιστήμες, που αποτελούν τη βάση της επιστημονικής κατανόησης
Έκδοση επίδειξης της ενδιάμεσης παρακολούθησης στη χημεία 2017 2018 ακαδημαϊκό έτος. (κατηγορία προφίλ, σχολικό βιβλίο Gabrielyan O.S.). 11η τάξη ( επίπεδο προφίλ) Επιλογή 5 Μέρος 1. Η απάντηση στις εργασίες 1 20 είναι η σειρά
ΕΓΚΕΚΡΙΜΕΝΗ Διάταξη του Υπουργού Παιδείας της Δημοκρατίας της Λευκορωσίας 12/03/2018 836 Εισιτήρια για εξωτερική εξέταση κατά την κατάκτηση του περιεχομένου εκπαιδευτικό πρόγραμμαδευτεροβάθμιας εκπαίδευσης σύμφωνα με την ακαδημαϊκή
ΕΓΚΡΙΘΗΚΕ Διάταγμα του Υπουργού Παιδείας της Δημοκρατίας της Λευκορωσίας 12/03/2018 836 Εισιτήρια για εξωτερική εξέταση κατά την εκμάθηση του περιεχομένου του εκπαιδευτικού προγράμματος της βασικής εκπαίδευσης στην ακαδημαϊκή
Επεξηγηματική σημείωση 8ης τάξης Αυτό το πρόγραμμα εργασίας βασίζεται στο Πρότυπο πρόγραμμα δευτεροβάθμιας (πλήρης) γενικής εκπαίδευσης στη χημεία (βασικό επίπεδο) για τις τάξεις 8-9, που προτείνεται με επιστολή
Δοκιμή με θέμα «Χημικός δεσμός» 11η τάξη 1. Σε αμμωνία και χλωριούχο βάριο χημικός δεσμόςαντίστοιχα 1) ιοντικό και ομοιοπολικό πολικό 2) ομοιοπολικό πολικό και ιονικό 3) ομοιοπολικό μη πολικό και μεταλλικό
Εργασίες Α9 στη χημεία 1. Ποιο οξείδιο αντιδρά με διάλυμα, αλλά δεν αντιδρά με διάλυμα; MgO Βασικό οξείδιο, αφού το Mg είναι μέταλλο με κατάσταση οξείδωσης +2. Τα βασικά οξείδια αντιδρούν με οξέα, οξείδια οξέος,
Εργασίες A16 στη χημεία 1. Η φορμαλδεΰδη δεν αντιδρά με τη φορμαλδεΰδη Η φορμαλδεΰδη είναι μυρμηκική αλδεΰδη, γνωστή και ως μεθανάλη. Ένα διάλυμα φορμαλδεΰδης 40% σε νερό ονομάζεται φορμαλίνη. Οι αντιδράσεις προσθήκης συμβαίνουν στην ομάδα καρβονυλίου
I. A. Gromchenko Συλλογή προβλημάτων στη χημεία για την τάξη 8 της Μόσχας Εκπαιδευτικό Κέντρο 109 2009 1. Κλάσμα μάζας ενός στοιχείου. Υπολογισμοί με χρήση τύπων. 1.1. Ποια ουσία έχει βαρύτερο μόριο: BaO, P 2 O 5, Fe 2 O 3; 1.2.
Επεξηγηματική σημείωση Η μελέτη της χημείας στο επίπεδο της βασικής γενικής εκπαίδευσης στοχεύει στην επίτευξη των ακόλουθων στόχων: κατάκτηση των πιο σημαντικών γνώσεων σχετικά με τις βασικές έννοιες και νόμους της χημείας, χημικό συμβολισμό.
1. Ποιο από τα παρακάτω στοιχεία είναι το πιο τυπικό αμέταλλο; 1) Οξυγόνο 2) Θείο 3) Σελήνιο 4) Τελλούριο 2. Ποιο από τα παρακάτω στοιχεία έχει τη μεγαλύτερη ηλεκτραρνητικότητα; 1) Νάτριο
Προγραμματισμένα αποτελέσματα μάθησης ακαδημαϊκό μάθημαΩς αποτέλεσμα της μελέτης της χημείας, ο μαθητής πρέπει: να γνωρίζει/κατανοεί χημικά σύμβολα: σύμβολα χημικών στοιχείων, τύπους ουσιών και χημικές εξισώσεις
Περίληψη στο πρόγραμμα εργασίας στη χημεία, τάξη 9. 1. Η θέση του μαθήματος στη δομή του βασικού εκπαιδευτικού προγράμματος του σχολείου. Πρόγραμμα εργασίαςστη χημεία για την 9η τάξη εφαρμόζεται σε μια τάξη γενικής εκπαίδευσης,
ΚΑΤΑΠΡΙΝΗ ΗΜΕΡΟΛΟΓΙΑΚΟΣ ΣΧΕΔΙΑΣΜΟΣ ΔΙΔΑΚΤΙΚΟΥ ΥΛΙΚΟΥ ΧΗΜΕΙΑ-8 2014/2015 ακαδημαϊκό έτος Συντάχθηκε με βάση το κρατικό πρόγραμμα Ε.Ε. Minchenkova με 2 ώρες την εβδομάδα (70 ώρες το χρόνο) Εργάζεται τον μισό χρόνο
FIPI Trial OGE 2018 στη χημεία Επιλογή προπόνησης 1 Προετοιμάστηκε από Mustafina Ekaterina Andreevna 1 Το παρακάτω σχήμα δείχνει ένα μοντέλο ατόμου 1) βόριο 2) αλουμίνιο 3) άζωτο 4) βηρύλλιο 2 ατομική ακτίνα
Έκδοση επίδειξηςενδιάμεση πιστοποίηση στη χημεία, τάξη 11, ακαδημαϊκό έτος 2017-2018 1. Εργασία Προσδιορίστε ποια άτομα δύο από τα στοιχεία που αναφέρονται στη σειρά έχουν ένα σε εξωτερικό ενεργειακό επίπεδο
Εργασίες Α20 στη χημεία 1. Ο ρυθμός αντίδρασης του αζώτου με το υδρογόνο θα μειωθεί με 1) μείωση της θερμοκρασίας 2) αύξηση της συγκέντρωσης αζώτου 3) χρήση καταλύτη 4) αύξηση της πίεσης Παράγοντες που επηρεάζουν
ΔΗΜΟΤΙΚΟ ΚΡΑΤΙΚΟ ΕΚΠΑΙΔΕΥΤΙΚΟ ΙΔΡΥΜΑ "Κεζέμσκι Δευτεροβάθμια Εκπαίδευση" Πρόγραμμα εργασιών του μαθήματος "χημεία" για μαθητές της 9ης τάξης, χωριό Kezhemsky 208 Προγραμματισμένα αποτελέσματα
Αυτό το πρόγραμμα εργασίας βασίζεται σε: Ομοσπονδιακός νόμοςμε ημερομηνία 29 Δεκεμβρίου 2012 273-FZ «Σχετικά με την εκπαίδευση στην Ρωσική Ομοσπονδία"; Η διαδικασία οργάνωσης και υλοποίησης εκπαιδευτικές δραστηριότητεςΜε
Δημοτικό δημοσιονομικό εκπαιδευτικό ίδρυμα δευτεροβάθμια εκπαίδευση No. 4 στο Baltiysk Πρόγραμμα εργασίας για το ακαδημαϊκό μάθημα «Χημεία» 9η τάξη, βασικό επίπεδο Baltiysk 2017 1. Επεξηγηματικά
Τράπεζα εργασιών 10η τάξη μέρος Γ (17 εργασία). Ενδιάμεση πιστοποίηση 2018. 1. Κυκλοπροπάνιο + KMnO 4 +H 2 SO 4 = 2. Κυκλοπροπάνιο + KMnO 4 +H 2 O = 3. Κυκλοπεντένιο + KMnO 4 +H 2 SO 4 = 4. CH 3 -CH 2 -CH=CH
ΕΙΣΙΤΗΡΙΑ ΕΞΕΤΑΣΕΩΝ ΓΙΑ ΤΗΝ ΚΡΑΤΙΚΗ ΤΕΛΙΚΗ ΠΙΣΤΟΠΟΙΗΣΗ ΣΤΗ ΧΗΜΕΙΑ ΓΙΑ ΠΡΟΓΡΑΜΜΑΤΑ ΒΑΣΙΚΗΣ ΓΕΝΙΚΗΣ ΕΚΠΑΙΔΕΥΣΗΣ Εισιτήριο 1 1. Περιοδικό σύστημα χημικών στοιχείων του D. I. Mendeleev και η δομή των ατόμων:
Υπουργείο Παιδείας και Επιστημών της Ρωσικής Ομοσπονδίας ΕΘΝΙΚΟ ΕΡΕΥΝΗΤΙΚΟ ΚΡΑΤΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ SARATOV ΟΝΟΜΑΣΜΕΝΟ Πρόγραμμα N.G.CHERNYSHEVSKY εισαγωγικό τεστγια πτυχίο/ειδικότητα
ΕΠΕΞΗΓΗΜΑΤΙΚΗ ΣΗΜΕΙΩΣΗ Κατάσταση του εγγράφου Το πρόγραμμα εργασίας στη χημεία καταρτίζεται για την 9η τάξη με βάση το Πρότυπο πρόγραμμα βασικής γενικής εκπαίδευσης στη χημεία. Το πρόγραμμα εργασίας ορίζει μια λίστα επιδείξεων,
Εργασίες προετοιμασίας 1. Όταν το θειούχο σίδηρο (II) κάηκε σε οξυγόνο, απελευθερώθηκαν 28 λίτρα διοξειδίου του θείου (σε όρους φυσιολογικές συνθήκες). Υπολογίστε τη μάζα της αρχικής ένωσης σιδήρου σε γραμμάρια. Απάντηση
4. Εργασίες για την εύρεση της μάζας (όγκος, ποσότητα μιας ουσίας), του κλάσματος μάζας (όγκου) του προϊόντος αντίδρασης και κλάσμα μάζας(μάζες) χημική ένωσηστο μείγμα. Η επίλυση ενός προβλήματος πρέπει να ξεκινά με ανάλυση
Φύλλο εργασίας τράπεζα χημεία βαθμού 9 1. Ένα στοιχείο έχει τρία ηλεκτρόνια στο 2ο επίπεδο ενέργειας. Ο ατομικός αριθμός του στοιχείου είναι 3 5 7 13 2. Πόσα ηλεκτρόνια βρίσκονται επάνω εξωτερικό επίπεδοστοιχείο με σειριακός αριθμός
Προϋποθέσεις για το επίπεδο προετοιμασίας των μαθητών Μετά τη μελέτη της ύλης της 9ης τάξης, οι μαθητές πρέπει: Ονοματεπώνυμο χημικά στοιχείαμε σύμβολα, ουσίες με τύπους, σημεία και συνθήκες για χημικές αντιδράσεις,
ΕΠΕΞΗΓΗΜΑΤΙΚΗ ΣΗΜΕΙΩΣΗ Το πρόγραμμα αναπτύχθηκε με βάση το πρόγραμμα του συγγραφέα N.N. Gara: Χημεία. Προγράμματα εργασίας. Θεματική γραμμή σχολικών βιβλίων των Γ. Ε. Ρουτζίτη, Φ. Γ. Φέλντμαν. 8 9 τάξεις: εγχειρίδιο για δασκάλους
Επιλογή 2589523 1. Προσδιορίστε ποια άτομα δύο από τα στοιχεία που υποδεικνύονται στη σειρά έχουν περισσότερα από πέντε ηλεκτρόνια στο εξωτερικό επίπεδο ενέργειας. Γράψτε στο πεδίο απάντησης τον αριθμό των επιλεγμένων στοιχείων.
Εργασίες Α27 στη χημεία 1. Ένα πολυμερές με τον τύπο λαμβάνεται από 1) τολουόλιο 2) φαινόλη 3) προπυλοβενζόλιο 4) στυρόλιο Το στυρόλιο (βινυλοβενζόλιο ή φαινυλαιθένιο) είναι ένα παράγωγο βενζολίου που έχει ένα ακόρεστο
1 Αυτό το πρόγραμμα εργασίας απευθύνεται σε μαθητές της 9ης τάξης στο πρόγραμμα βασικής γενικής εκπαίδευσης (βασικό επίπεδο) σύμφωνα με το Ομοσπονδιακό Εκπαιδευτικό Πρότυπο της Πολιτείας. Το πρόγραμμα εργασίας έχει σχεδιαστεί για 68 ώρες το χρόνο, 2 ώρες την εβδομάδα. βασικός
Νο. 1 Οι τύποι μόνο οξέων δίνονται στη σειρά
1.) HCl, NaCl, HNO3
2.) H2SO3, H2SO4, H2S
3.) Ca(OH)2, H3PO4, Ca3(PO4)2
4.) Na2O, NaNO3, HNO3
Νο. 2 Οι τύποι μόνο αλκαλίων δίνονται στη σειρά
1.) Fe(OH)2, ΚΟΗ, Ba(OH)2
2.) NaOH =, Ca(OH)2, Cu(OH)2
3.) KON, NaOH, LiOH
4.) Fe(OH)3, Cu(OH)2, NaOH
#3 Ένα οξείδιο που αντιδρά με το υδροξείδιο του νατρίου για να σχηματίσει ένα άλας
1.) Fe2O3
2.) K2O
3.) SO3
4.) BaO
Νο. 4 Η αλληλεπίδραση του οξειδίου με το νερό είναι αντίδραση
1.) Συνδέσεις
2.) Ανταλλαγή
3.) Αποσυνθέσεις
4.) Αντικαταστάσεις
#5 Μια ιδιότητα που είναι κοινή για τις αδιάλυτες βάσεις και τα αλκάλια είναι
1.) Αλληλεπίδραση με οξείδια οξέος
2.) Αλληλεπιδράσεις με οξέα
3.) Αλληλεπίδραση με άλατα
4.) Αποσύνθεση
Νο. 6 Δίνονται τύποι ουσιών
FeO, K2O, CO2, MgO, CrO, CrO3, SO2, P2O5
Γράψτε τους τύπους μόνο των κύριων οξειδίων.
Νο. 7 Καθιερώστε μια αλληλογραφία μεταξύ χημική φόρμουλαουσία και κατηγορία ανόργανες ενώσεις, στην οποία ανήκει.
1.) MgO Α) Οξέα
2.) H3PO4 Β) Αλκάλια
3.) Al(OH)3 Β) Οξείδια
4.) NaOH D) Αδιάλυτες βάσεις
Νο. 8 Συμπληρώστε τη δεξιά ή την αριστερή πλευρά της εξίσωσης της χημικής αντίδρασης
1.) ... + ... --> MgCl2 + H2
2.) LiOH + SO3 -->
Νο. 9 Κατανείμετε τις ουσίες σε κατηγορίες:
Mg(OH), CaCl2, BaC, H3PO4, Fe(OH)2, SiO2, HCl, Na2O, KOH, CO2, H2SO4, HgO, SO2, Na3PO4, HNO3.
Οξείδια -
Λόγοι -
Οξέα -
#10 Πραγματοποιήστε μια αλυσίδα μετασχηματισμών
Mg --> MgO --> Mg(OH)2 --> MgCl2
1) Βουτανόλη – 2 3) προπανικό οξύ
2) Μεθυλαιθυλαιθέρας 4) προπανάλη
Α2. Το αιθυλένιο αλληλεπιδρά με
1) υδροβρώμιο 2) άνθρακας 3) μεθάνιο 4) διοξείδιο του άνθρακα
Α3. Πεντανόλη – 1 αλληλεπιδρά με
1) αιθανοϊκό οξύ 2) αιθάνιο 3) διοξείδιο του άνθρακα 4) υδροξείδιο του αργιλίου
Α4. Η γλυκόζη εμφανίζει τις ιδιότητες των αλδεΰδων όταν αντιδρά με
1) Υδροξείδιο ασβεστίου 2) ανθρακικό κάλιο 3) προπανόλη – 1 4) διάλυμα αμμωνίας οξειδίου του αργύρου
Α5. Το ακετυλένιο μπορεί να ληφθεί στο εργαστήριο με υδρόλυση
1) καρβίδιο σιδήρου 2) ανθρακικός σίδηρος (11) 3) καρβίδιο αλουμινίου 4) καρβίδιο ασβεστίου
Α6. Στο σχήμα μετασχηματισμού
C2H4 → X → C2H5NH2 ουσία Χ είναι
1) Αιθανόλη 2) Διαιθυλαιθέρας 3) Διβρωμοαιθάνιο 4) Νιτροαιθάνιο
Α7. Μια ποιοτική αντίδραση στη φαινόλη είναι η αλληλεπίδρασή της με
1) Οξινισμένο διάλυμα υπερμαγγανικού καλίου
2) Βρωμιούχο νερό
3) Διάλυμα χλωριούχου σιδήρου (III).
4) Υδροξείδιο του χαλκού (II).
Α8. Η αλληλεπίδραση του προπενίου με το νερό αναφέρεται στις αντιδράσεις
1) Εστεροποίηση 2) προσθήκη 3) αντικατάσταση
Α9. Είναι σωστές οι κρίσεις για τις ιδιότητες της γλυκόζης;
Η Α. γλυκόζη ανήκει στους μονοσακχαρίτες - πεντόζες
Το διάλυμα γλυκόζης Β. δίνει μια αντίδραση καθρέφτη αργύρου
1) μόνο το Α είναι αληθές 3) και οι δύο κρίσεις είναι αληθείς
2) μόνο το Β είναι αληθές 4) και οι δύο κρίσεις είναι λανθασμένες
Α10. Ο διμεθυλαιθέρας σχηματίζεται όταν
1) Η αλληλεπίδραση του χλωρομεθανίου με το νάτριο
2) Ενυδάτωση αιθενίου
3) Αφυδάτωση με αιθανόλη
4) Οξείδωση με αιθανόλη
Μια 11. Η αντίδραση ξανθοπρωτεΐνης είναι ποιοτική αντίδρασηεπί
1) Αλκένια 2) αλκοόλες 3) πρωτεΐνες 4) υδατάνθρακες
Α12. Πραγματοποιείται δεσμός υδρογόνου
1) Σε μόριο αιθανόλης 3) σε μόριο αιθανίου
2) Μεταξύ μορίων αιθανίου 4) μεταξύ μορίων αιθανόλης
Α13. Το άτομο οξυγόνου στο μόριο της φαινόλης σχηματίζει δεσμούς σίγμα στην ποσότητα
1) Ένα 2) δύο 3) τρία 4) τέσσερα
1) αφυδρογόνωση, πολυμερισμός
2) αφυδάτωση, πολυμερισμός
3) ενυδάτωση, πολυμερισμός
4)πολυμερισμός, αφυδάτωση
2. Η αλληλεπίδραση αιθυλενίου και νερού αναφέρεται στις αντιδράσεις:
1) υδρόλυση
2) ενυδάτωση
3) υδρογόνωση
4) αφυδάτωση
3. Η παραγωγή ακετυλενίου από μεθάνιο αναφέρεται στις ακόλουθες αντιδράσεις:
1) αντικατάσταση
2) πολυμερισμός
3) προσχωρήσεις
4) αποσύνθεση
4. Το αιθυλένιο λαμβάνεται σε εργαστηριακές συνθήκες:
1) από αιθάνιο
2) από ακετυλένιο
3) από συνθετικό αέριο
4) από αιθυλική αλκοόλη