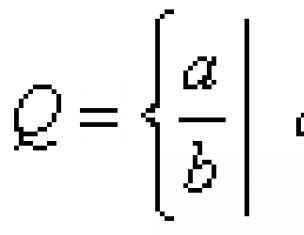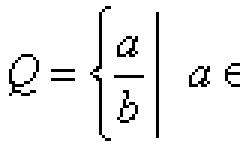ЯКОБ ВАНТ-ГОФФ
Вант- Гофф получил первую Нобелевскую премию по химии за открытие законов химической динамики и осмотического давления. Этой высокой наградой была отмечена важность молодой области науки -физической химии.
Ученый, пользовавшийся всеобщим уважением, член пятидесяти двух научных обществ и академий, почетный доктор многих высших учебных заведений, Вант-Гофф оставил после себя ряд основополагающих теорий, которые и в наши дни имеют непреходящее значение для химии. Представления, идеи и взгляды ученого сыграли большую роль в разработке основ современной минералогии, а также для развития биологии. В историю науки Вант-Гофф вошел как один из основателей стереохимии, учения о химическом равновесии и химической кинетике, осмотической теории растворов и химической геологии.
Якоб Хенрик Вант-Гофф родился 30 августа 1852 года в Голландии, в Роттердаме, в семье врача. Члены этого семейства неоднократно выбирались бургомистрами, занимали и другие выборные должности в городском самоуправлении.
Уже в начальной школе учителя заметили у мальчика любовь к музыке и поэзии. В дальнейшем он проявил замечательные способности к точным естественным наукам. По окончании школы в 1869 году Якоб поступил в политехникум в Дельфте. И здесь он по уровню знаний значительно превосходил своих сокурсников и потому в 1871 году без вступительного экзамена был принят в Лейденский университет. Позже в этом университете Вант-Гофф выдержал кандидатский экзамен.
Но в Лейдене ему не понравилось, и он уехал в Бонн к знаменитому химику Кекуле. После открытия молодым ученым пропионовой кислоты Кекуле порекомендовал своему ученику поехать в Париж к профессору Вюрцу, специалисту по органическому синтезу.
В Париже Якоб сблизился с французским химиком-технологом Жозефом Ашилем Ле Белем. Оба с интересом следили за исследованиями в области оптической изомерии, которые проводил Пастер.
В декабре 1874 года Вант-Гофф защитил докторскую диссертацию в университете Утрехта и в 1876 году начал преподавательскую деятельность в местной ветеринарной школе. Осенью 1874 года он опубликовал в Утрехте небольшую работу с длинным заглавием: «Предложение применять в пространстве современные структурные химические формулы вместе с примечаниями об отношении между оптической вращательной способностью и химической конституцией органических соединений».
Вант- Гофф ввел в науку положения, позволившие с новых позиций рассматривать строение химических соединений. Представление, согласно которому в молекуле метана четыре атома водорода равномерно распределены в пространстве и поэтому можно говорить о тетраэдрической форме молекулы, возвращает нас к взглядам Кекуле. В предложенной Вант-Гоффом модели четыре валентности атома углерода направлены к вершинам тетраэдра, в центре которого находится этот атом. Используя такую модель, Вант-Гофф предположил, что за счет связи атомов или атомных групп с углеродом тетраэдр может быть несимметричным, и высказал представление об асимметрическом атоме углерода. Он писал: «В случае, когда четыре сродства атома углерода насыщены четырьмя различными одновалентными группами, можно получить два и только два различных тетраэдра, которые представляют собой зеркальное отражение один другого и мысленно никак не могут быть совмещены, то есть мы имеем дело с двумя структурными формулами в пространстве».
Новая статья Вант-Гоффа «Химия в пространстве» (1875), где он высказал все эти соображения, послужила началом нового этапа в развитии органической химии. Вскоре он получил письмо от профессора Вислиценуса, одного из известнейших специалистов в этой области: «Я хотел бы получить согласие на перевод Вашей статьи на немецкий язык моим ассистентом доктором Германом. Ваша теоретическая разработка доставила мне большую радость. Я вижу в ней не только чрезвычайно остроумную попытку объяснить до сих пор непонятные факты, но верю также, что она в нашей науке… приобретет эпохальное значение».
Перевод статьи вышел в свет в 1876 году. К этому времени Вант-Гофф получил место ассистента физики в Ветеринарном институте в Утрехте.
Большая роль в популяризации новых взглядов Вант-Гоффа невольно досталась профессору Г. Кольбе из Лейпцига. В резкой форме он высказал свои замечания по поводу статьи голландского ученого: «Какой-то доктор Я.Г. Вант-Гофф из Ветеринарного института в Утрехте, видимо, не имеет вкуса к точным химическим исследованиям. Ему значительно удобнее воссесть на Пегаса (вероятно, взятого напрокат в Ветеринарном институте) и провозгласить в своей "Химии в пространстве", что, как ему показалось во время смелого полета к химическому Парнасу, атомы расположены в межпланетном пространстве». Естественно, каждого, кто прочел эту резкую отповедь, заинтересовала теория Вант-Гоффа. Так началось ее быстрое распространение в научном мире. Теперь Вант-Гофф мог бы повторить слова своего кумира Байрона: «Однажды утром я проснулся знаменитостью». Через несколько дней после опубликования статьи Кольбе Вант-Гоффу была предложена должность преподавателя в Амстердамском университете, а с 1878 года он стал профессором химии.
С 1877 по 1896 год Вант-Гофф был профессором химии, минералогии и геологии в незадолго до того основанном Амстердамском университете. Всегда рядом с ним была его жена Женни Вант-Гофф-Меес. Она успевала заниматься не только домом и детьми, но и сумела создать своему мужу настоящую творческую атмосферу.
Интересы Вант-Гоффа к поискам наиболее общих закономерностей вновь проявились в его большой работе «Воззрения на органическую химию». Но вскоре ученый перешел к изучению химической динамики. Свои взгляды по этому вопросу он изложил в книге «Очерки по химической динамике» (1884).
Вант- Гофф разработал учение о скорости реакций и тем самым создал основания химической кинетики. Он определял скорость реакции как закономерное, но далеко не всегда равномерное изменение концентрации реагирующих веществ в единицу времени. Ему удалось эту закономерность сформулировать в общем математическом виде. Установление зависимости скорости реакции от числа взаимодействующих молекул, а также тесно связанные с этим новые представления Вант-Гоффа о природе химического равновесия существенно способствовали значительному прогрессу теоретической химии.
При этом было выяснено, что химическое равновесие, рассматриваемое Вант-Гоффом как результат двух противоположно направленных реакций, идущих с одинаковой скоростью (обратимый процесс), зависит от температуры. Представления о химическом равновесии Вант-Гофф связал с уже известными в то время двумя началами термодинамики. Важнейшим результатом этой работы был вывод Вант-Гоффом математической формулы, в которой была отражена взаимосвязь температуры и теплоты реакции с константой равновесия. Эта закономерность сейчас известна как выведенное Вант-Гоффом уравнение изохоры реакции.
Еще одним крупным вкладом Вант-Гоффа в теоретическую химию во время амстердамского периода его деятельности было открытие аналогии осмотического и газового давления. На основании сформулированных Раулем эмпирических закономерностей о повышении точки кипения и понижении точки замерзания растворов Вант-Гофф в 1885 году разработал осмотическую теорию растворов.
К. Манолов рассказывает в своей книге, как ученый пришел к этому открытию: «Почему бы не представить систему в осмометре "вода - полупроницаемая перегородка - раствор" в виде цилиндра с поршнем? Раствор находится на дне цилиндра, поршень представляет собой перегородку, а над ним - вода. Это же основной метод термодинамики. Принципы газовой термодинамики применимы также к свойствам разбавленных растворов».
Вант- Гофф нарисовал цилиндр с поршнем, в пространстве под поршнем он написал «Раствор», а над поршнем -«Вода». Стрелки, направленные из раствора к воде, показывали, что в растворе существует давление, которое стремится поднять поршень вверх.
«Сначала надо рассчитать, какая работа требуется, чтобы поршень под действием осмотического давления передвинулся вверх, но можно и наоборот - выяснить, какая работа необходима, чтобы вернуть поршень вниз, преодолев осмотическое давление».
Вант- Гофф провел математические расчеты, заполняя лист формулами, и вот он, конечный результат!
«Невероятно! Зависимость точно такая же, как и для газов! Выражение абсолютно идентично уравнению Клапейрона-Клаузиуса!» Вант-Гофф взял лист и повторил все расчеты. «Тот же результат! Законы осмотического давления идентичны газовым законам. Если и константа имеет то же самое значение, тогда можно рассматривать молекулы разбавленного вещества как молекулы газа, представив себе, что растворитель удален из сосуда. Константу можно вычислить по данным Пфеффера». Он снова взял тетрадь, и перо быстро заскользило по бумаге. Для сахарных растворов константа имела такое же значение, что и газовая постоянная. Аналогия была полной».
Вант- Гофф установил, что растворенные молекулы производят осмотическое давление, равное тому давлению, которое оказывали бы те же молекулы, если бы они в газообразном состоянии заняли объем, равный объему раствора. Это фундаментальное открытие показало единство законов физики и химии (хотя причины возникновения осмотического давления не были вскрыты).
Вант- Гофф оказал также большое влияние на дальнейшее развитие теории диссоциации, изучив в своей работе «Химическое равновесие в системах газов и разбавленных растворов» (1886).
В марте 1896 года Вант-Гофф покинул Амстердам, переехав в Берлин по приглашению Прусской академии наук. В соответствии с предложением Макса Планка и Эмиля Фишера для Вант-Гоффа была создана специальная исследовательская лаборатория в Академии наук, а сам ученый был сразу же избран ее действительным членом и почетным профессором Берлинского университета.
В Германии он провел обширные экспериментальные и теоретические работы, которые помогли установить условия образования месторождений калийных солей и создать рациональную технологию их переработки.
Ученый был в Америке, когда узнал, что получил первую Нобелевскую премию по химии «в знак признания огромной важности открытия им законов химической динамики и осмотического давления в растворах». 10 декабря 1901 года в Стокгольме собрались выдающиеся ученые мира. Торжественная церемония в празднично освещенном зале Шведской Академии наук была действительно незабываема.
Вечером на банкете Вант-Гофф получил возможность выразить свою сердечную благодарность за большую честь, которой его удостоили, Комитету по Нобелевским премиям в области химии и лично его председателю, профессору П. Клеве.
Представляя ученого от имени Шведской королевской академии наук, С.Т. Однер назвал ученого основателем стереохимии и одним из создателей учения о химической динамике, а также подчеркнул, что исследования Вант-Гоффа «внесли значительный вклад в замечательные достижения физической химии».
В последующие дни, согласно требованиям Нобелевского комитета, награжденные должны были выступить с сообщениями о научных достижениях, за которые им была присуждена премия. Вант-Гофф в своей лекции говорил о теории растворов.
Ученый продолжал работать, но давняя тяжелая болезнь помешала Вант-Гоффу глубже изучить синтетическое действие ферментов в живом растительном организме.
Вант-Гоффа
(1852- 1911)
Нидерландский химик, один из основателей физической теории химии и стереохимии, Якоб Вант - Гофф родился 30 августа 1852
г. в Роттердаме в семье врача.
В 1869
г. Вант - Гофф закончил среднюю школу. И хотя он с детства мечтал про карьеру химика, но из-за желания родителей, начал изучать инженерное дело и даже проработал некоторое время на сахарном заводе.
В 1871
г. Вант - Гофф поступил на природно-математический факультет Лейденского университета, потом перешел в Боннский университет, что бы изучать химию. Вант-Гофф улучшал свои знания в Париже, через некоторое время вернулся в Нидерланды и в 1874
р. Защитил докторскую диссертацию по химии в Утрехтском университете.
Развитие научной карьеры Якоба шло очень медленно, хотя именно он первым (в 1874-
1875г
.) развил теорию пространственного размещения атомов в молекулах органических соединений, которая вскоре была положена в основу современной стереохимии. Только лишь в 1876г
. он занял должность лектора физики в Королевской ветеринарной школе в Утрехте. В 1878г
. Вант - Гофф становится профессором теоретической и физической химии в Амстердамском университете. В этом же году Якоб Вант - Гофф женился на дочке роттердамского купца Иоганной Франсиной Меес. У этой счастливой семейной пары было две дочки и два сына.
В 1896
г. Вант - Гофф перешел на пост профессора экспериментальной физики в Берлинский университет, где он имел в своем полном распоряжении полностью оборудованную лабораторию, и в то же время возможность заниматься исследовательской деятельностью.
В результате своих исследований Вант -Гофф вывел одно из основных уравнений термодинамики - уравнение изохоры, а также формулу зависимости химического способа от константы равновесия химической реакции при постоянной температур, то есть уравнение изотермы. Он разработал теорию разведенных розлогов, исходя из аналогии между веществами в газоподобном и растворимом состояниях, расширил закон идеалных газов на разведенные растворы и вывел закон осмотического давления (закон Вант - Гоффа). В 1890
г. ввел понятие твердых растворов, использовав свои представления к твердым телам.
В 1901
г. Вант - Гофф стал первым лауреатом Нобелевской премии по химии в знак признания огромной важности открытия им закона осмотического давления в растворах.
Кроме Нобелевской премии, Вант - Гофф был награжден медалями научных обществ разных стран, был членом европейских и американских химических и академий наук, ему было присвоено по ступени университетов Великой Британии и Америки.
Зависимость скорости протекания химической реакции от температуры определяется правилом Вант-Гоффа.
Голландский химик Вант-Гофф Якоб Хендрик, основатель стереохимии, в 1901 г. стал первым лауреатом Нобелевской премии по химии. Она была присуждена ему за открытие законов химической динамики и осмотического давления. Вант-Гофф ввёл представления о пространственном строении химических веществ. Он был уверен, что прогресса в фундаментальных и прикладных исследованиях по химии можно достичь, применяя физические и математические методы. Разработав учение о скорости реакций, он создал химическую кинетику.
Скорость химической реакции

Итак, кинетикой химических реакций называют учение о скорости протекания, о том, какое химической взаимодействие происходит в процессе реакций, и о зависимости реакций от различных факторов. У различных реакций скорость протекания различна.
Скорость химической реакции напрямую зависит от природы химических веществ, вступающих в реакцию. Некоторые вещества, такие как NаОН и НCl, способны реагировать за доли секунды. А некоторые химические реакции длятся годами. Пример такой реакции – ржавление железа.
Скорость реакции зависит также и от концентрации реагирующих веществ. Чем выше концентрация реагентов, тем выше и скорость реакции. В ходе реакции концентрация реагентов уменьшается, следовательно, замедляется и скорость реакции. То есть, в начальный момент скорость всегда выше, чем в любой последующий.
V = (C кон – С нач)/(t кон – t нач)
Концентрации реагентов определяют через определённые промежутки времени.
Правило Вант-Гоффа

Важным фактором, от которого зависит скорость протекания реакций, является температура.
Все молекулы сталкиваются с другими. Число соударений в секунду очень велико. Но, тем не менее, химические реакции не протекают с огромной скоростью. Так происходит, потому что в ходе реакции молекулы должны собраться в активированный комплекс. А образовать его могут только активные молекулы, кинетической энергии которых достаточно для этого. При малом количестве активных молекул реакция протекает медленно. При повышении температуры увеличивается число активных молекул. Следовательно, и скорость реакции будет выше.
Вант-Гофф считал, что скорость химической реакции – это закономерное изменение концентрации реагирующих веществ в единицу времени. Но оно не всегда является равномерным.
Правило Вант-Гоффа гласит, что при повышении температуры на каждые 10 о скорость химической реакции увеличивается в 2-4 раза .
Математически правило Вант-Гоффа выглядит так:
![]()
где V 2 t 2 , а V 1 – скорость протекания реакции при температуре t 1 ;
ɣ - температурный коэффициент скорости реакции. Этот коэффициент есть отношение констант скоростей при температуре t+10 и t .
Так, если ɣ = 3, а при 0 о С реакция длится 10 минут, то при 100 о С она будет продолжаться всего 0,01 сек. Резкое увеличение скорости протекания химической реакции объясняется увеличением количества активных молекул при повышении температуры.
Правило Вант-Гоффа применимо только в температурном диапазоне 10-400 о С. Не подчиняются правилу Вант-Гоффа и реакции, в которых участвуют большие молекулы.
Первую Нобелевскую премию по химии получил в 1901 г. Якоб Генрих Вант-Гофф за открытие законов химической динамики и осмотического давления. Этой высокой наградой была отмечена важность молодой области науки - физической химии.
Уже в первых работах Вант-Гофф привел веские доказательства положения: только применение физических и математических методов может обеспечить прогресс в фундаментальных и прикладных исследованиях по химии. Возникновение новых областей знания, таких, как стереохимия, стало возможно только в тесной связи с другими областями естествознания. Вант-Гофф стал основателем стереохимии. Он выступил с новыми воззрениями против всех неверных взглядов ярых агностиков и узколобых эмпириков и ввел в химию представления о пространственном строении веществ.
Вант-Гофф родился 30 августа 1852 г. в Роттердаме в семье врача. Роду Вант-Гоффа на протяжении ряда поколений принадлежало поместье вблизи голландского города Дортрехта. Члены этого семейства в течение многих десятилетий были бургомистрами или занимали другие выборные должности в городском самоуправлении.
Уже в начальной школе учителя заметили у юного Вант-Гоффа любовь к музыке и поэзии. В дальнейшем он проявил замечательные способности к точным естественным наукам. По окончании школы в 1869 г. будущий ученый поступил в политехникум в Дельфте. В годы учения Вант-Гофф особенно заинтересовался дифференциальным и интегральным исчислениями, которые в то время привлекали пристальное внимание многих.
Затем Вант-Гофф увлекся философией. Он основательно изучил "Курс позитивной философии" О. Конта, в котором обратил внимание на путь, приводящий к рациональному исследования) в химии. Вант-Гофф понял высказывание Конта как способ логического совершенствования химических знаний. Но Вант-Гофф не воспринял ни враждебности Конта к теории, ни его ограниченной механистической методологии. Напротив, Вант-Гофф признавал необходимость единства теории и практики; он никогда не придерживался односторонней эмпирической точки зрения, а позже защищал свои материалистические представления от "энергетизма" Оствальда.
В политехникуме Дельфта Вант-Гофф по уровню знаний значительно превосходил своих сокурсников и потому в 1871 г. без вступительного экзамена был принят в Лейденский университет. Позже в этом университете Вант-Гофф выдержал кандидатский экзамен. Помимо интереса к математике в нем опять вспыхнула "старая любовь к химии", и Вант-Гофф продолжил свое химическое образование в наиболее известных тогда центрах этой науки - в лабораториях Кекуле в Бонне и Вюрца в Париже. В это время Кекуле - автор теории строения бензола и создатель представлений о порядке расположения атомов в молекулах - считался одним из ведущих специалистов в области фундаментальных проблем химии. Восхищение личностью этого ученого и его работами вызвало у Вант-Гоффа интерес к изучению строения молекул. Но Вант-Гофф недолго пробыл в Бонне. Работая у Вюрца в Париже, он познакомился с Ле Белем, который одновременно с Вант-Гоффом и независимо от него создал известную тетраэдрическую модель углеродного атома на основе представлений Кекуле о пространственном расположении атомов в молекуле.

В декабре 1874 г. Вант-Гофф защитил докторскую диссертацию в университете Утрехта и в 1876 г. начал преподавательскую деятельность в местной ветеринарной школе. Осенью 1874 г, он опубликовал в Утрехте небольшую работу с длинным заглавием: "Предложение применять в пространстве современные структурные химические формулы вместе с примечаниями об отношении между оптической вращательной способностью и химической конституцией органических соединений"37. Ни эта работа, опубликованная на голландском языке, ни ее перевод на французский язык (Роттердам, 1875) не привлекли внимания химиков. Подлинная известность пришла после того, как Вислиценус - решительный сторонник новой науки стереохимии 38 - познакомил ученых в 1877 г. с немецким переводом этой сильно переработанной статьи Вант-Гоффа, названной теперь "Расположение атомов в пространстве". Этот перевод был опубликован с предисловием Вислиценуса 39 .
Вант-Гофф ввел в науку положения, позволившие с новых позиций рассматривать строение химических соединений. Представление, согласно которому в молекуле метана СН 4 четыре атома водорода равномерно распределены в пространстве и поэтому можно говорить о тетраэдрической форме молекулы, возвращает нас к взглядам Кекуле 40 . Они нашли отражение в предложенной Вант-Гоффом модели: четыре валентности атома углерода направлены к вершинам тетраэдра, в центре которого находится этот атом 41 . Используя такую модель, Вант-Гофф предположил, что за счет связи атомов или атомных групп с углеродом тетраэдр может быть несимметричным, и высказал представление об асимметрическом атоме углерода. Он писал: "В случае, когда четыре сродства атома углерода насыщены четырьмя различными одновалентными группами, можно получить два и только два различных тетраэдра, которые представляют собой зеркальное отражение один другого и мысленно никак не могут быть совмещены, то есть мы имеем дело с двумя структурными формулами в пространстве" 42 .
Явления оптической изомерии нельзя было понять, используя существовавшие в то время структурные формулы. Замечательным достижением Вант-Гоффа явилось установление связи между наличием в соединении асимметрического атома углерода и оптической изомерией вещества. Голландский ученый считал бесспорным, что оба оптических изомера соответствуют двум молекулярным моделям с зеркальной симметрией по отношению к асимметрическому атому углерода. Следовательно, каждое оптически активное соединение содержит асимметрический атом углерода. Это предположение легко можно было проверить экспериментально, Вант-Гофф подтвердил свою гипотезу о существовании пространственных структурных формул при экспериментальном изучении многочисленных оптически активных соединений.
В этой работе Вант-Гофф объяснил также другой вид изомерии, которую Вислиценус назвал "геометрической изомерией". Такова, например, изомерия кислот фумаровой (транс -бутендикарбоновой) и малеиновой (цис -бутендикарбоновой). Их структурные формулы одинаковы, а свойства различны. Для объяснения этого явления Вант-Гофф опять использовал тетраэдрическую модель атома углерода, связав тем самым пространственное строение и химические свойства веществ. Так было вновь доказана важное значение мысленных моделей в химии.
Несмотря на изучение философии Конта, Вант-Гофф был материалистом и стихийным диалектиком. Своими выступлениями и результатами исследований Вант-Гофф последовательно защищал атомно-молекулярное учение от нападок философов-идеалистов, а в 90-х годах и от сторонников энергетизма Оствальда. Наиболее сильный удар идеализму нанесло открытие Вант-Гоффом стереохимии. Еще в 1871 г. Эрнст Мах представил многочисленные и, по его мнению, неопровержимые доводы, что "химические элементы не могут существовать в пространстве из трех змерений". Вант-Гофф выступил как против этих идеалистических утверждений, так и против взглядов Кольбе, высказанных в рецензии на работы Вант-Гоффа.

Герман Кольбе (1818-1884); автор многочисленных статей в издаваемом под его редакцией "Журнале практической химии"; в которых он выступал против стереохимических представлений Вант-Гоффа
В 1877 г. вскоре после выхода немецкого перевода статьи Вант-Гоффа Кольбе в грубой полемической форме писал: "Некоему доктору Я. Г. Вант-Гоффу, занимающему должность в ветеринарной школе Утрехта, очевидно не по вкусу точные химические исследования. Он счел более приятным сесть на Пегаса (вероятно взятого напрокат из ветеринарной школы) и поведать миру то, что узрел с химического Парнаса в своем смелом полете-расположение атомов в мировом пространстве" 43 . В другом месте статьи Кольбе читаем: "Примечательно для нашего времени, бедного критиками и ненавидящего критику, что два почти неизвестных химика, один из которых работает в ветеринарной школе, а другой - в сельскохозяйственном институте 44 , с уверенностью обсуждают одну из наиболее сложных проблем химии, которую, пожалуй, никому не решить: вопрос о расположении атомов в пространстве - и объяснения даются с такой дерзостью, которая просто обескураживает подлинных естествоиспытателей" .
Неверие в возможность познания мира, презрение к теоретическому мышлению, диалектике и материализму привели Кольбе к борьбе против передовых идей в естествознании. Стереохимические воззрения Вант-Гоффа постепенно получили подтверждение и применение не только в органической химии 45 , но спустя 20 лет и в неорганической химии 46 . Соотношения, установленные для асимметрического атома углерода, были успешно использованы в 1890 г. Альфредом Вернером для объяснения случаев изомерии у асимметрического атома азота.
С 1877 по 1896 г. Вант-Гофф был профессором химии, минералогии и геологии в незадолго до того основанном Амстердамском университете. Там он выполнил многие ценные теоретические работы. При этом Вант-Гоффу удалось счастливо сочетать смелость в выдвижении идей и тщательность их разработки. Работы Вант-Гоффа показали, что изучение основополагающих химических закономерностей - процесс, требующий от исследователя не только настойчивости, но и фантазии. В лекции, прочитанной Вант-Гоффом при вступлении в должность профессора Амстердамского университета, ученый говорил, что без "фантазии в науке" не может обойтись ни подготовка эксперимента, ни объяснение полученных результатов. Для изучения этого вопроса Вант-Гофф прочитал более двухсот жизнеописаний математиков И естествоиспытателей. Такой стиль работы восхищал учеников и друзей Вант-Гоффа.

Интересы Вант-Гоффа к поискам наиболее общих закономерностей вновь проявились в его большой работе "Воззрения на органическую химию" (т. I-II, 1878-1881). Исходя из представлений об асимметрическом атоме углерода, он хотел в этой работе раскрыть наиболее общие закономерности соотношений между строением и химическими свойствами органических соединений. Однако решению этих вопросов в то время мешало явно недостаточное знание строения атомов и молекул. Даже в наши ни многие проблемы, важные для теоретических основ органической химии, пока не решены.
Вант-Гофф вскоре перешел к изучению химической динамики; позднее он изложил свои взгляды по этому вопросу в книге "Очерки по химической динамике"47 (1884 г.). Голландский физикохимик разработал учение о скорости реакций и тем самым создал основания химической кинетики. Он определял скорость реакции как закономерное, но далеко не всегда равномерное изменение концентрации реагирующих веществ в единицу времени. Ему удалось эту закономерность сформулировать в общем математическом виде. Установление зависимости скорости реакции от числа взаимодействующих молекул, а также тесно связанные с этим новые представления Вант-Гоффа о природе химического равновесия существенно способствовали значительному прогрессу теоретической химии.
При этом было выяснено, что химическое равновесие, рассматриваемое Вант-Гоффом как результат двух противоположно направленных реакций, идущих с одинаковой скоростью (обратимый процесс) 48, зависит от температуры. Представления о химическом равновесии Вант-Гофф связал с уже известными в то время двумя началами термодинамики. Важнейшим результатом этой работы был вывод Вант-Гоффом математической формулы, в которой отражена взаимосвязь температуры и теплоты реакции с константой равновесия. Эта закономерность сейчас известна как выведенное Вант-Гоффом уравнение изохоры реакции 49 .
В разработке учения о химическом равновесии на термодинамической основе значительную роль сыграли исследования Ле-Шателье, Горстмана и Гиббса.
Одним из наиболее значительных открытий этого времени было установление природы движущей силы реакции - химического сродства. Это понятие не было точно определено 50 . Томсен в 1854 г. и Бертло в 1868 г. пытались сделать это, но успеха не добились 51 .
Вант-Гофф в 1885 г. высказал мысль, что мерой сродства может служить работа реакции, и вывел для нее математическое выражение 52 . В него, однако, не входила константа равновесия из закона действия масс, сформулированного в общем виде в 1867 г. Гульдбергом и Вааге на основе представления о вероятности столкновения друг с другом реагирующих молекул. В 1885 г. Вант-Гоффу удалось вывести этот закон термодинамически, что сразу увеличило возможность его практического применения.
Последним крупным вкладом Вант-Гоффа в теоретическую химию во время амстердамского периода его деятельности было открытие аналогии осмотического и газового давления. На основании сформулированных Раулем эмпирических закономерностей о повышении точки кипения и понижения точки замерзания растворов Вант-Гофф в 1885 г. разработал осмотическую теорию растворов. Он показал аналогию поведения растворенных веществ и газов и установил, что уравнение состояния идеальных газов PV = RT при его использовании для описания осмотического давления в растворах имеет вид PV = iRT (i > 1 - коэффициент, характеризующий отклонение поведения некоторых веществ) 53 , Осмотическое давление растворов было впервые измерено в 1877 г. ботаником Пфеффером, который пользовался искусственно приготовленными полупроницаемыми перепонками 54 . Вант-Гофф смог понять, что это явление характерно вообще для химических процессов. Вант-Гофф установил, что растворенные молекулы производят осмотическое давление, равное тому давлению, которое оказывали бы те же молекулы, если бы они в газообразном состоянии заняли объем, равный объему раствора. Такое объяснение было дано найденным Пфеффером высоким значениям осмотического давления 55 . Это фундаментальное открытие показало единство законов физики и химии (хотя причины возникновения осмотического давления не были вскрыты).

Вант-Гофф оказал также большое влияние на дальнейшее развитие теории диссоциации, изучив в своей работе "Химическое равновесие в системах газов и разбавленных растворов" (опубликована в Стокгольме на французском языке в 1886 г.56) природу зависимости между понижением температуры замерзания растворителя, давлением пара раствора и осмотическим давлением солей, кислот и оснований.
Совместно с Вильгельмом Оствальдом Вант-Гофф стал издавать с 1887 г. Журнал физической химии. В первом выпуске этого журнала кроме статьи Вант-Гоффа с изложением осмотической теории растворов была опубликована также работа Сванте Аррениуса, в которой подтверждались и развивались взгляды голландского ученого.
В 1890 г. Вант-Гофф сформулировал понятие о твердых растворах 57 .
В марте 1896 г. Вант-Гофф покинул Амстердам, переехав Берлин по приглашению Прусской Академии наук. В соответчик с предложением Макса Планка и Эмиля Фишера для Вант-Гоффа была создана специальная исследовательская лаборатория в Академии наук, а сам ученый был сразу же избран ее действительным членом и почетным профессором Берлинского университета. В Берлине он проводил обширные экспериментальные и теоретические работы, которые помогли установить условия образования месторождений калийных солей и создать рациональную технологию переработки таких веществ. Результаты этих исследований (проводившихся с 1897 по 1903 г.) были опубликованы в двух выпусках (1905 и 1909 гг.) под заглавием "К образованию океанических соляных месторождений" 58 .
Давняя тяжелая болезнь Вант-Гоффа помешала ему глубже изучить синтетическое действие ферментов в живом растительном организме. Сделанный ученым в 1900 г. прогноз "химик дойдет своими синтезами до клетки, которая как органическая материя сейчас изучается биологами" блестяще подтвердился в наши дни. Именно эта задача встала перед специалистами в новой области исследований, которую разрабатывают совместно химики и биологи.

Ученый, пользовавшийся всеобщим уважением, член пятидесяти двух научных обществ и академий 59 , первый лауреат Нобелевской премии по химии (1901 г.), кавалер медалей Дэви, Гельмгольца и других, прусского ордена "За заслуги в науках и искусствах", почетный доктор многих высших учебных заведений, Вант-Гофф оставил после себя ряд основополагающих теорий, которые и в наши дни имеют непреходящее значение для химии. Представления, идеи и взгляды Вант-Гоффа сыграли большую роль в разработке основ современной минералогии, а также для развития биологии. В историю науки Вант-Гофф вошел как один из основателей стереохимии, учения о химическом равновесии и химической кинетике, осмотической теории растворов и химической геологии 60 .
Нидерландский химик Якоб Хендрик Вант-Гофф родился в Роттердаме, в семье Алиды Якобы (Колф) Вант-Гофф и Якоба Хендрика Вант-Гоффа, врача и знатока Шекспира. Он был третьим по счету ребенком из семи родившихся у них детей. Свои первые химические опыты В.-Г., ученик роттердамской городской средней школы, которую он окончил в 1869 г., ставил дома. Он мечтал о карьере химика. Однако родители, считая научно-исследовательскую работу неперспективной, уговорили сына начать изучать инженерное дело в Политехнической школе в Дельфте. В ней В.-Г. за два года прошел трехлетнюю программу обучения и лучше всех сдал выпускной экзамен. Там же он увлекся философией, поэзией (особенно произведениями Джорджа Байрона) и математикой, интерес к которым пронес через всю жизнь.
Проработав недолгое время на сахарном заводе, В.-Г. в 1871 г. стал студентом естественно-математического факультета Лейденского университета. Однако уже на следующий год он перешел в Боннский университет, чтобы изучать химию под руководством Фридриха Августа Кекуле. Два года спустя будущий ученый продолжил свои занятия в Парижском университете, где и завершил работу над диссертацией. Вернувшись в Нидерланды, он представил ее к защите в Утрехтском университете.
Еще в самом начале XIX в. французский физик Жан Батист Био заметил, что кристаллические формы некоторых химических веществ могут изменять направление проходящих через них лучей поляризованного света. Научные наблюдения показали также, что некоторые молекулы (их назвали оптическими изомерами) вращают плоскость света в направлении, противоположном тому, в котором его вращают другие молекулы, хотя и первые, и вторые представляют собой молекулы одного типа и состоят из одинакового числа атомов. Наблюдая этот феномен в 1848 г., Луи Пастер выдвинул гипотезу, что такие молекулы являются зеркальным отображением друг друга и что атомы таких соединений расположены в трех измерениях.
В 1874 г., за несколько месяцев до защиты диссертации, В.-Г. опубликовал статью на 11 страницах под названием «Предложение применять в пространстве современные структурно-химические формулы вместе с примечанием об отношении между оптической вращательной способностью и химической конструкцией органических соединений» ("An Attempt to Extend to Space the Present Structural Chemical Formulae. With an Observation on the Relation Between Optical Activity and the Chemical Constituents of Organic Compounds").
В этой статье он предложил альтернативный вариант двухмерных моделей, которые в то время использовались для изображения структур химических соединений. В.-Г. предположил, что оптическая активность органических соединений связана с асимметрической молекулярной структурой, причем атом углерода находится в центре тетраэдра, а в четырех его углах располагаются атомы или группы атомов, отличающиеся друг от друга. Таким образом, взаимообмен расположенных в углах тетраэдра атомов или групп атомов может приводить к появлению молекул, идентичных по химическому составу, но являющихся зеркальным отображением друг друга по структуре. Этим и объясняются различия в оптических свойствах.
Двумя месяцами позже во Франции к подобным же выводам пришел работавший над этой проблемой независимо от В.-Г. его товарищ по Парижскому университету Жозеф Ашиль Ле Бель. Распространив концепцию тетраэдрального асимметрического атома углерода на соединения, содержащие углерод-углеродные двойные связи (общие края) и тройные связи (общие грани), В.-Г. утверждал, что эти геометрические изомеры обобществляют края и грани тетраэдра. Поскольку теория Вант-Гоффа – Ле Беля была чрезвычайно противоречивой, В.-Г. не решился представить ее в качестве докторской диссертации. Вместо этого он написал диссертацию о цианоуксусной и малоновой кислотах и в 1874 г. получил докторскую степень по химии.
Соображения В.-Г. об асимметрических атомах углерода были опубликованы в нидерландском журнале и не произвели большого впечатления до тех пор, пока двумя годами позднее его статья не была переведена на французский и немецкий языки. Сначала теория Вант-Гоффа – Ле Беля была высмеяна известными химиками, такими, как А.В. Герман Кольбе, который назвал ее «фантастической чепухой, напрочь лишенной какого бы то ни было фактического основания и совершенно непонятной серьезному исследователю». Однако со временем она легла в основу современной стереохимии – области химии, изучающей пространственное строение молекул.
Становление научной карьеры В.-Г. шло медленно. Вначале ему приходилось давать по объявлениям частные уроки химии и физики, и только в 1976 г. он получил должность лектора физики в Королевской ветеринарной школе в Утрехте. В следующем году он становится лектором (а позднее профессором) теоретической и физической химии Амстердамского университета. Здесь в течение последующих 18 лет он каждую неделю читал по пять лекций по органической химии и по одной лекции по минералогии, кристаллографии, геологии и палеонтологии, а также руководил химической лабораторией.
В отличие от большинства химиков своего времени В.-Г. имел основательную математическую подготовку. Она пригодилась ученому, когда он взялся за сложную задачу изучения скорости реакций и условий, влияющих на химическое равновесие. В результате проделанной работы В.-Г. в зависимости от числа участвующих в реакции молекул классифицировал химические реакции как мономолекулярные, бимолекулярные и многомолекулярные, а также определил порядок химической реакции для многих соединений.
После наступления химического равновесия в системе с одинаковой скоростью протекают и прямые, и обратные реакции без каких бы то ни было конечных превращений. Если в такой системе увеличивается давление (меняются условия или концентрация ее компонентов), точка равновесия сдвигается таким образом, чтобы давление уменьшилось. Этот принцип был сформулирован в 1884 г. французским химиком Анри Луи Ле Шателье. В том же году В.-Г. применил принципы термодинамики при формулировании принципа подвижного равновесия, возникающего в результате изменения температуры. Тогда же он ввел общепринятое сегодня обозначение обратимости реакции двумя стрелками, направленными в противоположные стороны. Результаты своих исследований В.-Г. изложил в «Очерках по химической динамике» ("Etudes de dynamique chimique"), опубликованных в 1884 г.
В 1811 г. итальянский физик Амедео Авогадро установил, что в равных объемах любых газов при одинаковых температуре и давлении содержится одинаковое число молекул. В.-Г. пришел к заключению, что этот закон справедлив и для разбавленных растворов. Сделанное им открытие было очень важным, поскольку все химические реакции и реакции обмена внутри живых существ происходят в растворах. Ученый также экспериментально установил, что осмотическое давление, представляющее собой меру стремления двух различных растворов по обе стороны мембраны к выравниванию концентрации, в слабых растворах зависит от концентрации и температуры и, следовательно, подчиняется газовым законам термодинамики. Проведенные В.-Г. исследования разбавленных растворов явились обоснованием теории электролитической диссоциации Сванте Аррениуса. Впоследствии Аррениус переехал в Амстердам и работал вместе с В.-Г.
В 1887 г. В.-Г. и Вильгельм Оствальд приняли активное участие в создании «Журнала физической химии» ("Zeitschrift fur Physikalische Chemie"). Оствальд незадолго до этого занял вакантное место профессора химии Лейпцигского университета. В.-Г. тоже предлагали эту должность, но он отклонил предложение, так как Амстердамский университет заявил о своей готовности построить ученому новую химическую лабораторию. Однако, когда В.-Г. стало очевидно, что осуществляемая им в Амстердаме педагогическая работа, а также исполнение административных обязанностей мешают его исследовательской деятельности, он принял предложение Берлинского университета занять место профессора экспериментальной физики. Было оговорено, что здесь он будет читать лекции только раз в неделю и в его распоряжение будет отдана полностью оборудованная лаборатория. Это произошло в 1896 г.
Работая в Берлине, В.-Г. занялся применением физической химии для решения геологических проблем, в частности при анализе океанических соляных отложений в Стасфурте. До первой мировой войны эти отложения почти полностью обеспечивали углекислым калием производство керамики, моющих средств, стекла, мыла и особенно удобрений. В.-Г. начал также заниматься проблемами биохимии, в частности изучением ферментов, которые служат катализаторами химических изменений, необходимых для живых организмов.
В 1901 г. В.-Г. стал первым лауреатом Нобелевской премии по химии, которая была ему присуждена «в знак признания огромной важности открытия им законов химической динамики и осмотического давления в растворах». Представляя В.-Г. от имени Шведской королевской академии наук, С.Т. Однер назвал ученого основателем стереохимии и одним из создателей учения о химической динамике, а также подчеркнул, что исследования В.-Г. «внесли значительный вклад в замечательные достижения физической химии».
В 1878 г. В.-Г. женился на дочери роттердамского купца Иоганне Франсине Меес. У них было две дочери и два сына.
Через всю свою жизнь В.-Г. пронес живой интерес к философии, природе, поэзии. Он умер от туберкулеза легких 1 марта 1911 г. в Германии, в Стеглице (теперь это часть Берлина).
Помимо Нобелевской премии, В.-Г. был награжден медалью Дэви Лондонского королевского общества (1893) и медалью Гельмгольца Прусской академии наук (1911). Он был членом Нидерландской королевской и Прусской академий наук, Британского и Американского химических обществ, американской Национальной академии наук и Французской академии наук. В.-Г. были присвоены почетные степени Чикагского, Гарвардского и Йельского университетов.